
Badania genetyczne raka – co to takiego?
Nowotwór nie jest chorobą jednorodną. Różnice występują nie tylko na poziomie organów, z których wywodzi się guz, lecz także poszczególnych typów histologicznych. Pacjenci różnią się od siebie. Każdy guz nowotworowy jest niepowtarzalny i charakterystyczny dla danego chorego. Dzieje się tak dlatego, że rak jest chorobą genów. Rozwija się w wyniku uszkodzeń DNA. Uszkodzenia takie, nazywane mutacjami, rearanżacjami czy fuzjami genów powodują zmianę metabolizmu obciążonych nimi komórek, a dotyczą najczęściej genów regulujących ich wzrost i namnażanie. Prawidłowe komórki, które są w równowadze metabolicznej, stają się komórkami o potencjale nowotworowym. Wymykają się spod kontroli i zaczynają dzielić, dając początek chorobie nowotworowej. W różnych typach nowotworów inicjacja tego procesu powodowana jest przez różne uszkodzenia DNA, a z progresją choroby mogą być związane inne zaburzenia. Znane są zaburzenia genów specyficzne dla określonego nowotworu lub grupy nowotworów (markery diagnostyczne). Znane są uszkodzenia, których obecność wpływa na przewidywany przebieg choroby (markery prognostyczne) lub takie, których obecność zapowiada reakcję na leczenie (markery predykcyjne).
W przypadku niektórych nowotworów, wykonuje się badania genetyczne w celu poszukiwania takich swoistych uszkodzeń (tzw. biomarkerów nowotworowych). Są to bardzo dokładne i precyzyjne testy pozwalające na analizę ludzkiego materiału genetycznego.
Badania genetyczne przeprowadzane są przy użyciu różnych testów laboratoryjnych. Testy te realizowane są metodami biologii molekularnej. W celu wykonania takiego badania konieczne jest pobranie próbki materiału genetycznego. W zależności od sytuacji klinicznej, badanie genetyczne wykonuje się w tkance guza lub materiale komórek krwi lub szpiku kostnego, pobranych od pacjenta. W przypadku tkanki guza – najczęściej wykorzystuje się jego fragment uzyskany w trakcie operacji lub biopsji.
Zasadnicze znaczenie dla powodzenia oznaczenia ma obecność komórek nowotworu w badanej tkance. W innym przypadku, ocena obejmująca komórki prawidłowe nie ma szans na wykrycie zmian charakterystycznych dla komórek guza nowotworowego.
Dlaczego badania genetyczne są takie ważne?
W onkologii badania genetyczne mają dwojakie znaczenie. Testy te mogą być przydatne w ocenie predyspozycji genetycznej. Poszukiwany jest wtedy gen, uszkodzony we wszystkich komórkach organizmu, który może być przekazywany z pokolenia na pokolenie. Badania takie przeprowadza się w przypadku podejrzenia rodzinnego występowania choroby nowotworowej. Testom poddaje się osobę dotkniętą nowotworem oraz – jeśli mutacja zostanie potwierdzona – także członków jej rodziny, a materiałem do badania jest tkanka prawidłowa (np. krew czy komórki nabłonka znajdujące się w ślinie).
Odmienne znaczenie ma badanie genetyczne tkanki guza nowotworowego. Jego celem jest określenie występowania swoistych dla nowotworu biomarkerów. Przeprowadzenie takiego badania jest niezwykle ważne. Pozwala przede wszystkim na zaplanowanie optymalnego leczenia, z ewentualnym wykorzystaniem leków celowanych. W przypadku niektórych nowotworów określono bowiem kluczowe mutacje, które odpowiedzialne są za rozwój i postęp choroby. Jeżeli lekarze stwierdzą, że nowotwór u danego chorego ma określone cechy, które mogą zostać zablokowane lekami wdraża się leczenie spersonalizowane. Niezbędnym warunkiem powodzenia leczenia celowanego w przypadku wybranych nowotworów jest dokładna ocena materiału genetycznego guza.
Czym jest medycyna personalizowana
Idea i założenia medycyny personalizowanej
Choroby są podobne, ale pacjenci różni. Każdy z nas jest niepowtarzalny, wyjątkowy i w zależności od indywidualnych cech własnego organizmu inaczej również choruje. Dlaczego więc mamy być leczeni w ten sam sposób, tymi samymi metodami czy lekami?
Każdy z nas posiada indywidualny i unikatowy kod DNA. To w nim zawarte są wszystkie nasze „dane”. Zakodowany jest w nim kolor włosów, karnacja, cechy fizyczne i charakteru, a także predyspozycje do uczuleń i chorób. Informacja genetyczna odnosi się do budowy i sposobu funkcjonowania całego organizmu człowieka. Zbadanie kodu genetycznego pozwala z wysokim prawdopodobieństwem określić, co w przyszłości może stać się przyczyną problemów zdrowotnych pacjenta (Zielińska A., 2016).
Pomimo tego, że informacja zawarta w DNA jest niepowtarzalna, to jednocześnie nie jest ona niezmienna. Wraz z postępującym wiekiem organizmu pojawiają się w niej różne zmiany. Zazwyczaj, organizm daje sobie z nimi radę, aktywizując liczne mechanizmy naprawcze. Niestety, niekiedy mechanizmy zawodzą i zmiany doprowadzają do wystąpienia procesu chorobowego (Grzanka M., 2015).
Przykładem są nowotwory, których powstanie i rozwój jest skutkiem szczególnego uszkodzenia materiału genetycznego (DNA) w komórkach określonych tkanek czy narządów. Podłoże genetyczne nowotworu może być dwojakie. W nowotworach sporadycznych (ok. 90% wszystkich nowotworów) takie uszkodzenia DNA zachodzą (gromadzą się) w trakcie życia pacjenta i występują tylko w komórkach guza. W nowotworach dziedzicznych, występujących rodzinnie (1-10% wszystkich nowotworów), geny predysponujące do ewentualnego rozwoju choroby przekazywane z pokolenia na pokolenie, są obecne we wszystkich komórkach pacjenta. Uszkodzenia materiału genetycznego są skutkiem procesów nazywanych mutacjami, rearanżacjami lub fuzjami genów. Zaburzenia te dotyczą często genów regulujących wzrost, namnażanie i różnicowanie komórek. Tak zmienione geny produkują nieprawidłowe białka, co powoduje zmianę metabolizmu obciążonych nimi komórek. W ten sposób komórki wymykają się spod kontroli i zaczynają nadmiernie dzielić, dając początek chorobie nowotworowej.
Badanie wykrywające rodzaj uszkodzeń może być ważnym czynnikiem stosowanym z jednej strony w profilaktyce, do określenia obciążeń genetycznych i podjęcia próby zapobiegnięcia lub wczesnego wykrycia choroby dziedzicznej, z drugiej strony w diagnostyce, do określenia cech już istniejącej choroby nowotworowej (biomarkerów), wybrania odpowiedniej terapii m.in. leków celowanych.
Kiedy zaczynamy poważnie chorować, prowadzone leczenie może okazać się w różnym stopniu skuteczne w zależności od indywidualnych cech konkretnego pacjenta czy jego nowotworu. Badania pokazują, że terapia skierowana przeciwko jednemu typowi nowotworu, może przynieść u różnych pacjentów diametralnie różne odpowiedzi. U części chorych będzie skuteczna, u części obojętna, a części będzie szkodzić (Grzanka M., 2015). Unikalne cechy genetyczne guza mogą być bowiem zróżnicowane, nawet w nowotworach tak samo klasyfikowanych. Wiemy też, że u niektórych chorych pewne leki nigdy nie przejdą w formę aktywną. Jest to związane z uwarunkowanymi genetycznie różnicami w aktywności wybranych enzymów (Wysocki P., 2009).

W tradycyjnej medycynie od wieków stosowane były ujednolicenia, łączenie chorób i ich objawów w jednolite grupy oraz stosowanie jednolitego leczenia (Fronczak A., 2016). Jednak wraz z rozwojem genetyki i badań genomu pozyskiwana jest wiedza, która odwraca te trendy, udowadniając, że wiele chorób, w szczególności chorób nowotworowych zależy od zmian na poziomie genomu, mutacji, rearanżacji i fuzji genów (Fronczak A., 2016). To właśnie te badania wykorzystuje medycyna personalizowana w onkologii, określając leczenie celowane, dostosowane do pacjenta oraz zdefiniowanej na poziomie molekularnym choroby nowotworowej (Wysocki P., 2009).
Medycyna personalizowana to całkiem nowe podejście do procesu diagnostyczno-terapeutycznego, zmieniające paradygmat opieki (Fronczak A., 2016). To identyfikowanie odmienności chorego (komórek jego nowotworu), a następnie zastosowanie właściwie dobranego leku.
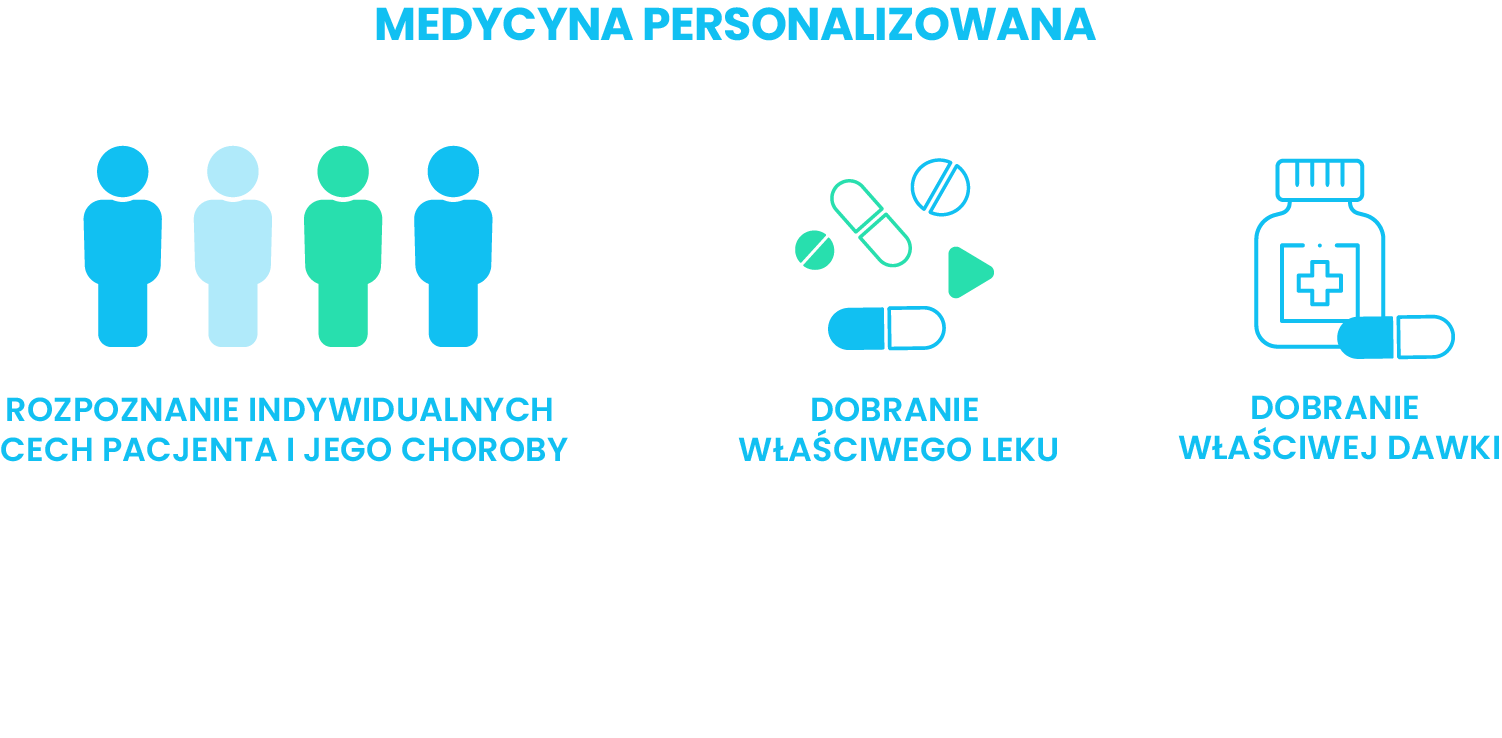
Onkologia stanowi awangardę terapii personalizowanej. W związku z tym, że przez lata nie było czym leczyć pacjentów, albo ich leczenie nie zawsze było skuteczne, nastąpił intensywny rozwój badań molekularnych i immunologicznych nad nowotworami oraz czynnikami powodującymi ich złośliwy charakter. Już 20 lat temu wiadomo było, że obecność pewnych białek na powierzchni lub wewnątrz komórki nowotworowej jest jednoznacznie związana z określoną diagnozą lub jest równoznaczna z bardzo złym rokowaniem dla pacjenta (Pieńkowska-Grela B., 2013). Dopiero po określeniu roli tych białek, wskazano je jako potencjalny cel terapii i zaczęto projektować leki, mające za zadanie łączyć się z nimi, wyłączać je i hamować ich wpływ na rozwój komórek nowotworowych (Wysocki P., 2009).
Medycyna personalizowana może pomóc zwiększyć efektywność procesu leczenia nowotworu złośliwego, bo stosowane w niej metody i substancje czynne skierowane są na poznanie nieprawidłowego mechanizmu będącego przyczyną choroby, a następnie znalezienie odpowiedniego leku. Dokładnie wiedząc, na co pacjent jest chory i czym go leczyć, w zależności od uwarunkowań genetycznych możemy modyfikować terapię celowaną, np. zmieniając rodzaj leku lub jego dawkę (Gaciong Z., Halota W., 2009).
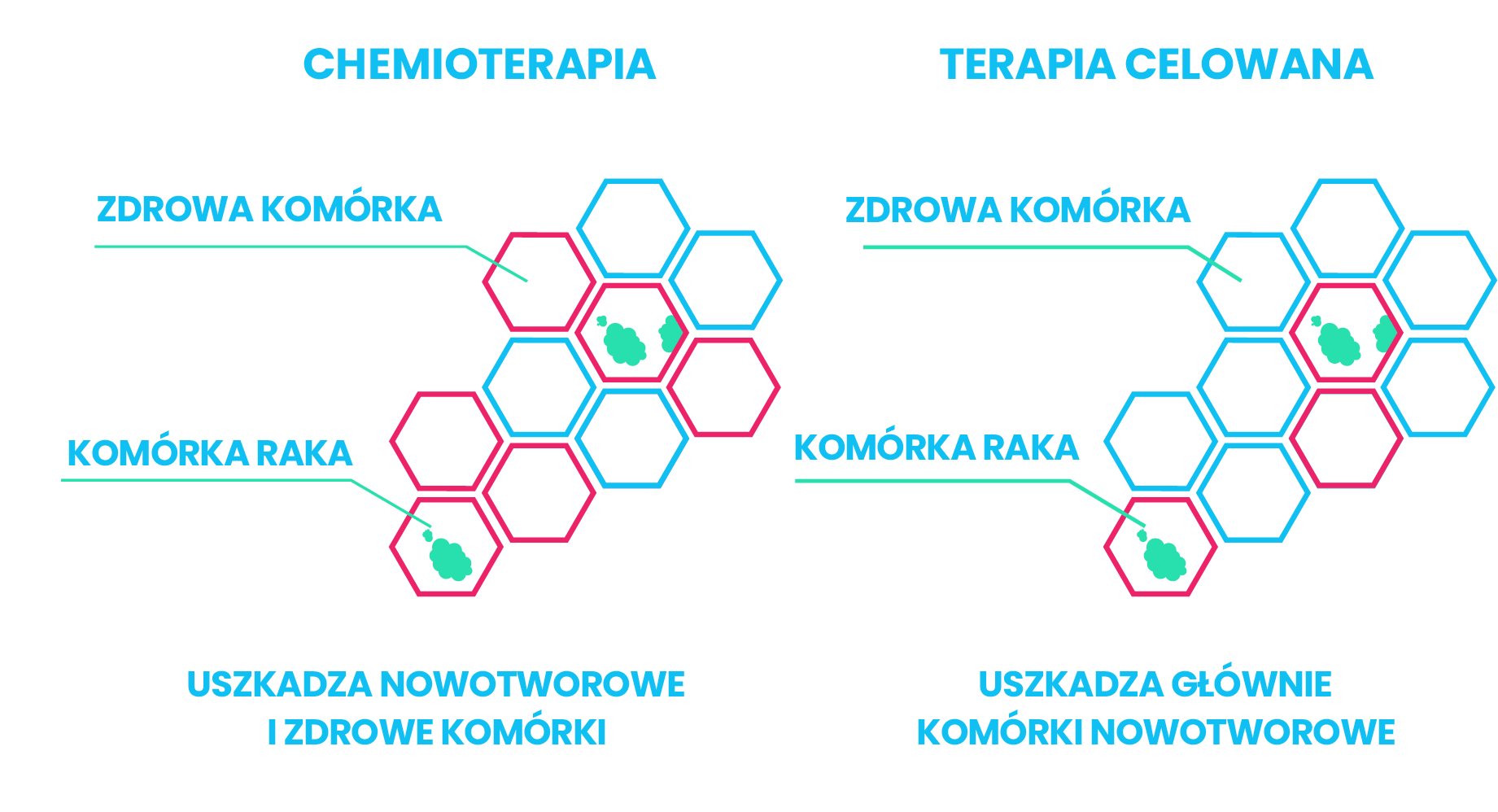
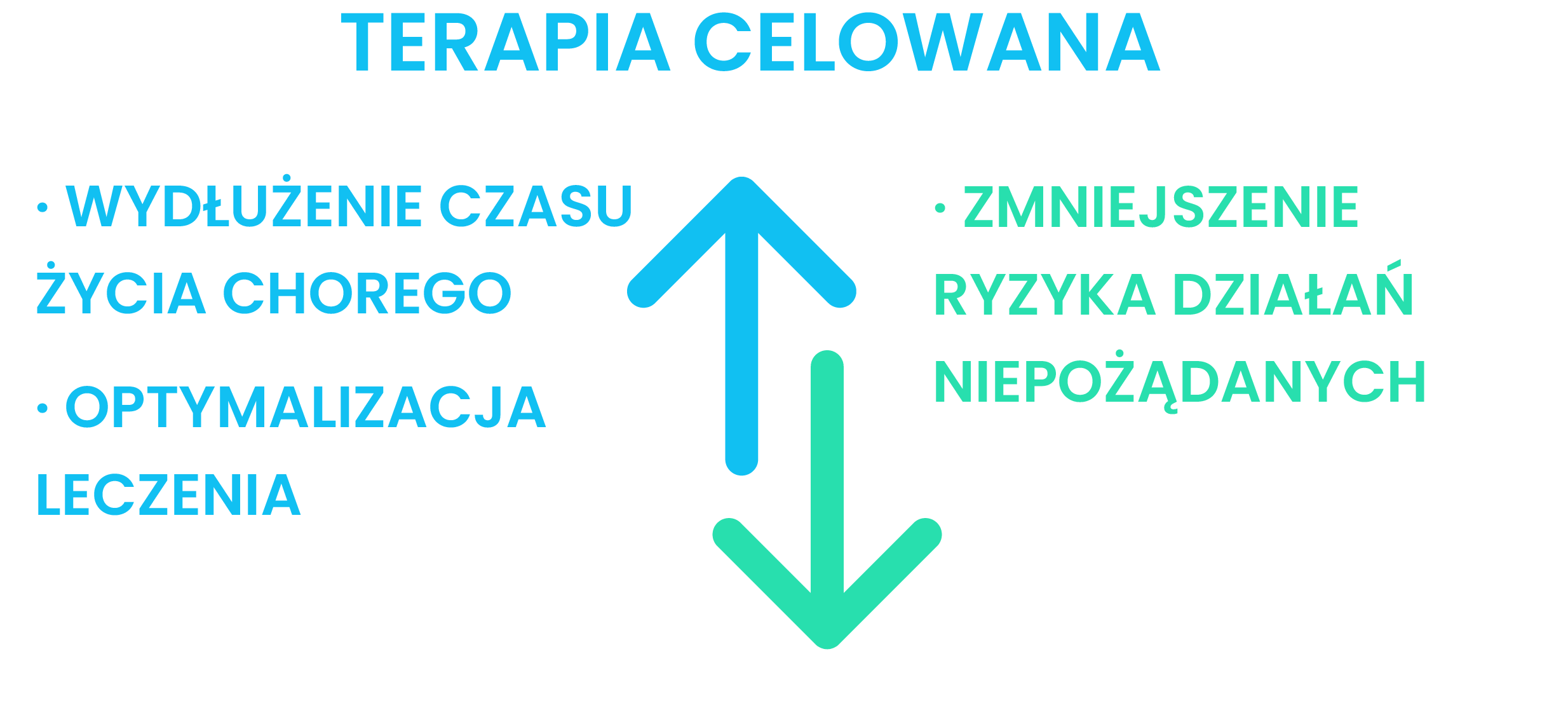
Terapia ukierunkowana molekularnie uderza w określony cel, jakim jest nieprawidłowe (zmutowane) białko w tkance nowotworowej. Taka mutacja znajduje się tylko w komórkach raka, zdrowe komórki posiadają prawidłowy gen. Dzięki temu terapia jest bardzo precyzyjna. Różni się od chemioterapii, która uszkadza wszystkie dzielące się komórki w organizmie, zarówno nowotworowe, jak i zdrowe, dając przy tym dużo efektów ubocznych. Leczenie celowane działa przede wszystkim na komórki nowotworowe, wpływając na komórki zdrowe w znacznie mniejszym stopniu niż chemioterapia Stosowane leki blokują mechanizmy odpowiedzialne za nadmierne rozmnażanie i nagromadzenie komórek nowotworu. Prowadzi to do zahamowania podziałów i śmierci komórek nowotworowych. Najczęstszymi grupami leków celowanych, używanymi w praktyce klinicznej są: przeciwciała monoklonalne i inhibitory kinaz tyrozynowych.
Podsumowując, medycyna personalizowana to całość działań medycznych, dostosowanych do konkretnego pacjenta, ustalenie jego wybranych, unikatowych cech biologicznych i zastosowanie leków oraz innych procedur medycznych uwzględniających wiedzę na temat jego indywidualnych cech. W ten sposób ukierunkowane leczenie nazywane leczeniem celowanym lub terapią spersonalizowaną przynosi największe korzyści medyczne, społeczne i ekonomiczne (Kucharz E., 2009).
Po co są badania genetyczne raka?
Badania genetyczne w leczeniu celowanym nowotworów
Kluczowy element w leczeniu celowanym nowotworu, stanowi pogłębiona diagnostyka przeprowadzona przy pomocy badań genetycznych (cytogenetycznych i molekularnych). Oceniany materiał stanowi DNA wyodrębnione z wycinków guza nowotworowego, komórek nowotworowych obecnych w płynach ustrojowych, wolnego surowiczego DNA pochodzącego z komórek nowotworowych lub komórek (leukocytów / limfocytów / granulocytów) krwi obwodowej bądź szpiku kostnego. Analiza genów, przeprowadzana najczęściej metodami i technikami biologii molekularnej, dostarcza informacji o zaburzeniach, występujących w ich obrębie (Nikliński J., Niklińska W., Chyczewski L., 2000). Poszukiwane są mutacje (lub inne zaburzenia genetyczne) stanowiące swoiste biomarkery nowotworowe.
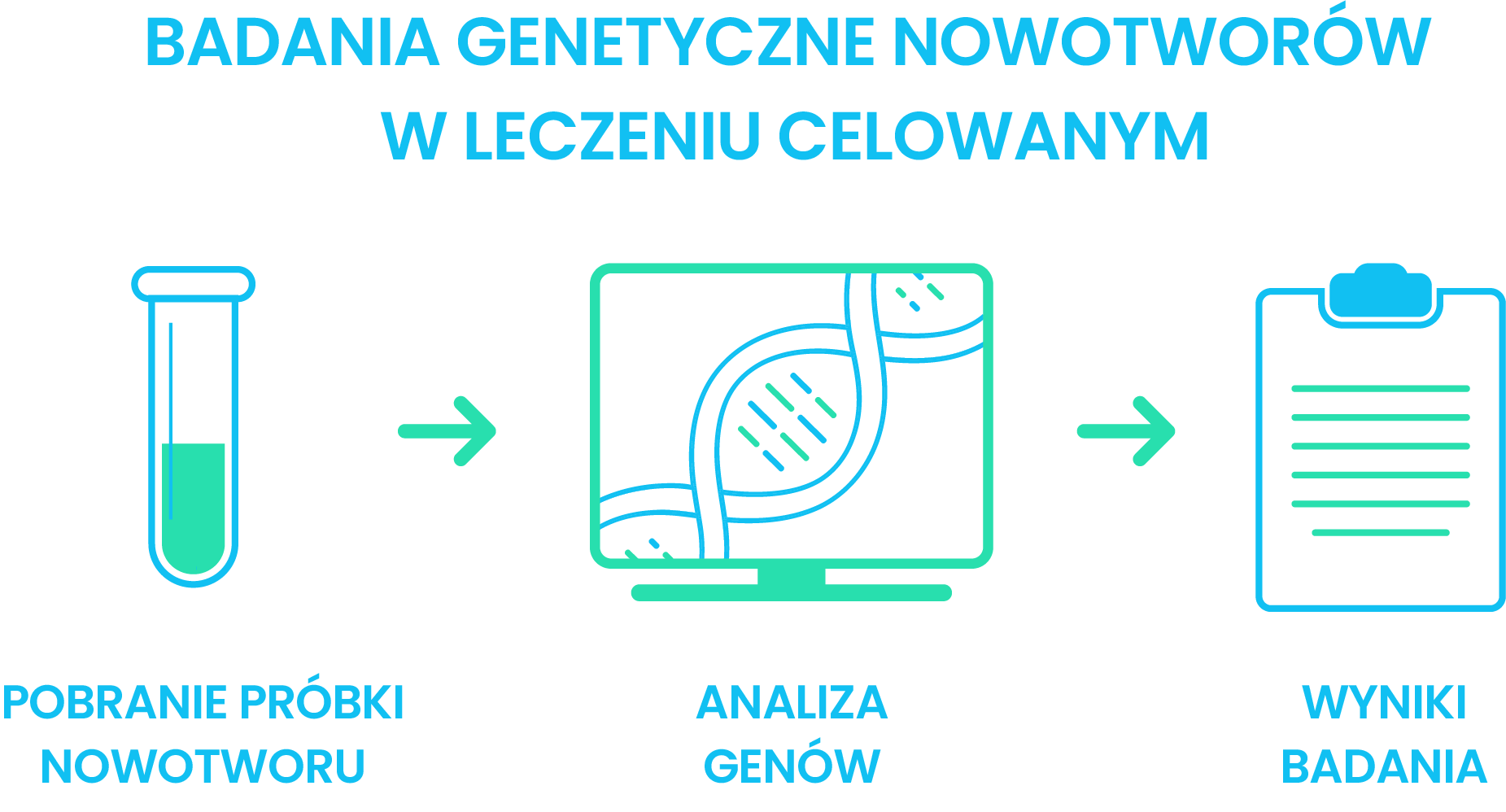
Badania molekularne opierają się na analizie genów związanych z procesem nowotworzenia. Podczas pojedynczego badania można przeanalizować bardzo dokładnie kilkadziesiąt genów (Grzanka D., 2015). Pierwszą kategorię informacji stanowi dokładna analiza mutacji, nadekspresji, fuzji, jej lokalizacja, a także określenie charakteru.
Koszt sekwencjonowania ludzkiego genomu w 2001 roku wynosił 300 milionów dolarów, w roku 2014 roku koszt ten wynosił 1 000 dolarów (Hsiao CJ , Hing E., 2014, pkmp.org.pl).

W nowotworach najczęściej występują mutacje 2 grup genów tj.: onkogenów i genów supresorowych. Mutacje onkogenów doprowadzają do powstania wadliwego białka przekształcającego zdrową komórkę w komórkę nowotworową. Geny supresorowe co do zasady hamują podziały komórkowe, jednak w przypadku ich mutacji lub utraty funkcja ta może zostać zablokowana (Grzanka D., 2015).
W przypadku niektórych nowotworów, określono kluczowe mutacje, które odpowiedzialne są za rozwój i postęp choroby. Jeżeli lekarze stwierdzą, że nowotwór u danego chorego ma określone cechy, na które zostały opracowane leki celowane – wdraża się leczenie spersonalizowane.
Wykrycie zmiany charakteryzującej rozwój konkretnego nowotworu stanowi odpowiedź na zapytanie o przyczynę jego powstania. Po jej poznaniu, można zaordynować leczenie najbardziej odpowiednią substancją, która będzie niwelować skutki wady DNA. Przykładowo, jeżeli mutacja prowadzi do powstania zbyt dużej liczby receptorów na powierzchni komórek rakowych (jak w ok. 20% przypadków nowotworów piersi), najbardziej efektywna będzie terapia lekiem hamującym aktywność tych receptorów (Grzanka D., 2015).
Nowotwór jest strukturą niestabilną genetycznie. W trakcie jego rozwoju (progresji) w jego komórkach pojawiają się kolejne zaburzenia genetyczne. U różnych pacjentów będą zachodziły inne uszkodzenia pozwalające komórce nowotworowej na przeżycie, niekontrolowany podział i nabywanie oporności na leczenie. Personalizacja w procesie leczenia powinna umożliwiać szybkie reagowanie na to, co dzieje się z nowotworem (wybór najbardziej efektywnej w danym okresie terapii) i pacjentem (przeciwdziałanie niepożądanym skutkom) (Wysocki P., 2009).
73% rozwijanych leków onkologicznych należy do terapii personalizowanych (Tufts Center for the Study of Drug Development 2015., pkmp.org.pl).

Badania molekularne powinny być wykonywane chorym na raka piersi, raka jelita grubego, raka płuca, raka jajnika, czerniaka, nowotworów podścieliskowych przewodu pokarmowego (ang. GastroIntestinal Stromal Tumors, GIST), raka żołądka, raka prostaty, raka tarczycy lub przewlekłą białaczkę szpikową, przewlekłą białaczkę limfocytową, ale też w przypadku diagnozowania innych nowotworów układu krwiotwórczego i chłonnego. Wymienione nowotwory charakteryzują się występowaniem określonych mutacji, a wykrycie ich pozwala na wdrożenie odpowiedniego postępowania. W większości przypadków możliwe jest zastosowanie nowoczesnej terapii celowanej lekami oddziałującymi na zablokowanie wykrytego uszkodzenia genetycznego.
Leczenie celowane – czyli jakie?
Leczenie celowane jest stosunkowo młodym podejściem terapeutycznym w onkologii, jednocześnie niezwykle cennym. Umożliwia bowiem dostarczenie właściwego leczenia, dostosowanego do charakterystyki genetycznej indywidualnego guza i zniszczenie komórek nowotworowych. Biologia każdego nowotworu różni się, dlatego leczenie powinno być dopasowane do konkretnej zmiany. Terapia ukierunkowana molekularnie uderza w określony cel, jakim jest nieprawidłowe białko, powstałe na matrycy zmutowanego genu w tkance nowotworowej. Taka mutacja znajduje się tylko w komórkach raka, zdrowe komórki posiadają prawidłowy gen. Dzięki temu terapia jest bardzo precyzyjna. Różni się od chemioterapii, która uszkadza wszystkie dzielące się komórki w organizmie, zarówno nowotworowe, jak i zdrowe, dając przy tym dużo efektów ubocznych. Leczenie celowane działa przede wszystkim na komórki nowotworowe, wpływając na komórki zdrowe w znacznie mniejszym stopniu niż chemioterapia. Leczenie celowane nie jest jednak całkowicie pozbawione działań niepożądanych. Toksyczność terapii personalizowanej jest mniejsza niż klasycznej chemioterapii, ale z uwagi na fakt, że leki celowane stosuje się długotrwale – nawet mało nasilone, ale nieprzerwane działania niepożądane (np. biegunka, osłabienie, stan zapalny skóry) mogą powodować konieczność czasowego przerwania lub nawet zakończenia leczenia. Z tego powodu leczenie celowane musi być prowadzone i nadzorowane przez onkologów klinicznych mających doświadczenie w zapobieganiu i zwalczaniu działań niepożądanych tych terapii.
Mechanizm działania leków ukierunkowanych molekularnie polega przede wszystkim na zahamowaniu wzrostu komórek nowotworowych oraz blokowaniu rozwoju sieci naczyń krwionośnych odżywiających guz.
Najczęstszymi grupami leków używanymi w praktyce klinicznej są:
Terapię spersonalizowaną wykorzystuje się obecnie w leczeniu m.in. czerniaka, raka piersi, raka jelita grubego, raka głowy i szyi, raka jajnika, raka trzonu macicy, raka żołądka, raka urotelialnego, raka płuca, przewlekłej białaczki szpikowej, przewlekłej białaczki limfocytowej, ostrej białaczki limfoblastycznej, szpiczaka plazmocytowego, a także nowotworów podścieliskowych przewodu pokarmowego (GIST).
Zalety i skuteczność
Zalety i skuteczność terapii personalizowanej
Zastosowanie medycyny personalizowanej wpływa na zwiększenie skuteczności leczenia chorych. Tradycyjny, standardowy model leczenia i podawania leków de facto opierał się na metodzie prób i błędów. Z badań wynika, że skuteczność leków waha się w granicach 50-70%, co pokazuje zróżnicowanie chorych i chorób, tak pozornie jednolitych (Kucharz E., 2009). Zastosowanie leczenia celowanego, poprawia te statystyki, np. w raku piersi umożliwia zmniejszenie ryzyka zgonu o 30% w porównaniu do wcześniej stosowanych schematów leczenia (Wysocki P., 2009).
Liczba leków, znaczących terapii i narzędzi diagnostycznych w medycynie personalizowanej w latach od 2006 do 2014 wzrosła z 13 do 113.
Liczba ważnych leków, przykładów znaczących terapii i narzędzi diagnostycznych stosowanych w medycynie personalizowanej w latach od 2006 do 2014 wzrosła z 13 do 113 (Personalized Medicine Coalition, pkmp.org.pl).
Uzasadnione stosowanie leczenia personalizowanego jest, w ostatecznym rezultacie, tańsze od standardowych terapii (np. chemioterapii), bo pacjent od razu dostaje lek, który działa na chorobę. Środki finansowe nie są wydawane na nieskuteczne terapie. Szacuje się, że możliwe jest zmniejszenie o 34% wykorzystania chemioterapii, gdyby wszystkim kobietom chorym na raka piersi w USA wykonywano badania genetyczne przed rozpoczęciem leczenia. Podobnie, poprzez przeprowadzanie badań molekularnych na obecność mutacji genów KRAS/NRAS u amerykańskich pacjentów z rakiem jelita grubego pozwoliłoby na wygenerowanie oszczędności na poziomie 604 milionów dolarów rocznie (Shankaran V., 2009., pkmp.org.pl). Podobne wyliczenia przeprowadził również m.in. Narodowy Instytut Raka we Francji (ema.europe.eu).

Medycyna personalizowana może wpłynąć na zmianę charakteru choroby nowotworowej, z choroby wiążącej się z wysoką śmiertelnością (w Polsce rocznie ok. 130 tys. zachorowań i ok. 90 tys. zgonów) w chorobę przewlekłą. Personalizacja leczenia pozwala na znaczne wydłużenie czasu życia chorego wraz z zachowaniem satysfakcjonującej jego jakości (Wysocki P., 2009). To właśnie dlatego w okresie ubiegłych 5 lat inwestycje finansowe w medycynę personalizowaną na świecie wzrosły.
Ważnym argumentem przemawiającym za terapią personalizowaną jest optymalizacja leczenia i zmniejszenie ryzyka działań niepożądanych.
Terapia celowana umożliwia prowadzenie monitoringu efektywności realizowanego procesu leczenia choroby nowotworowej. Kiedy na podstawie indywidualnej informacji genetycznej osoby chorej dokonany zostanie wybór odpowiedniego modelu leczenia, możliwe jest monitorowanie jej skuteczności, czy określenie tendencji do przerzutowania stałych guzów nabłonkowych, poprzez badanie obecności wolnokrążących komórek nowotworowych w krwi pacjenta. Udowodniono, że te komórki mogą się ujawnić nawet 5 miesięcy przed jawnymi klinicznymi przerzutami. Monitorowanie liczby komórek nowotworowych umożliwia minimalizację ryzyka wznowy choroby (Grzanka D., 2015).
Leczenie spersonalizowane można uznać za jedno z najważniejszych osiągnięć współczesnej onkologii, stale ewoluujące i rozwijające się poprzez intensywną pracę biologów, genetyków, bioinformatyków, biotechnologów, farmakologów i lekarzy. Skutkiem tych działań jest ogromny postęp w medycynie i farmakologii, wymuszający opracowywanie receptur nowych leków. Na świecie prowadzone są badania, dzięki którym włączono do terapii nowotworów wiele nowych cząsteczek. W kolejce do zatwierdzenia czeka około czterystu następnych. Dostępna jest coraz większa wiedza dotycząca molekularnego podłoża chorób oraz wpływu genów i ich mutacji. Dzięki temu możliwe jest opracowywanie kolejnych, bardziej skutecznych leków na choroby nowotworowe. W połączeniu z wiedzą o indywidualnych cechach konkretnego pacjenta, uzyskujemy możliwość wdrożenia skutecznego procesu leczenia (Grzanka D., 2015).
Badania genetyczne, wykorzystywane w diagnostyce i leczeniu nowotworów umożliwiają wykrycie mutacji pojawiających się w trakcie trwania życia chorego. Równocześnie istnieją przypadki, kiedy mutacje są dziedziczone po rodzicach. W takiej sytuacji, gdy badanie wykaże mutację skutkującą rozwojem nowotworu, a pacjent nie ma objawów choroby, możliwe jest wdrożenie terapii prewencyjnej (Grzanka D., 2015).
Uniwersalne testy wielogenowe
W ostatnim czasie obserwuje się postęp technologiczny w zakresie rozbudowanych badań genetycznych (jednoczasowe badanie mutacji w obrębie kilkuset genów czyli tzw. sekwencjonowanie) nowej generacji – NGS. Takie badania dają możliwość szybkiej oceny, czy w komórkach danego nowotworu występują zaburzenia genetyczne, które mogłyby stanowić potencjalny cel dla terapii celowanych (nie tylko najbardziej znane, pojedyncze mutacje, takie jak np.: mutacje C-KIT, EGFR, PDGFR, BRAF itp.).
Próby leczenia w oparciu o wykryte w komórkach guza rzadkie bądź nowo odkryte zaburzenia genetyczne, prowadzi się w wielu ośrodkach na świecie, jednak nigdzie takie postępowanie nie jest uznanym standardem. Najnowsze publikacje podsumowujące doświadczenia kilkudziesięciu największych światowych ośrodków onkologicznych wskazują, że 30-40% chorych z wykrytym potencjalnie istotnym zaburzeniem genetycznym, nie uzyskuje korzyści z leczenia ukierunkowanego na ten cel. Tym samym, takie postępowanie nie stanowi obecnie praktyki klinicznej i musi być realizowane wyłącznie w ramach badań klinicznych.
W USA rozpoczęto w 2015 roku szeroko zakrojone badanie kliniczne TAPUR mające ostatecznie odpowiedzieć na pytanie czy poszukiwanie zaburzeń genetycznych, które mogłyby stanowić cel terapeutyczny i stosowanie leków ukierunkowanych na te zaburzenia przynosi rzeczywiste korzyści w kontekście poprawy przeżycia oraz poprawy jakości życia pacjentów. Należy pamiętać, że w ramach badań klinicznych zarówno diagnostyka genetyczna, jak i leczenie są dla chorych bezpłatne.
W Polsce i większości innych krajów Europy leki celowane refundowane są w konkretnych przypadkach (np. erlotynib, gefitynib – tylko w raku płuca z mutacją EGFR, wemurafenib, dabrafenib – tylko w czerniaku z mutacją BRAF), co wynika z faktu, że badania kliniczne, które potwierdziły aktywność ww. leków, były przeprowadzane właśnie w takich sytuacjach klinicznych.
Tym samym, nawet w przypadku wykazania konkretnego zaburzenia genetycznego, ale nietypowego dla danego guza, np. mutacji BRAF w raku jelita grubego, czy mutacji EGFR w raku dróg żółciowych, nie ma możliwości zastosowania leków refundowanych i rutynowo stosowanych w innych nowotworach.
Wykonanie badania
Jak i gdzie wykonać badanie genetyczne nowotworu?
1. Skierowanie na badania genetyczne nowotworu
Jeżeli chorujesz na raka piersi, pewne podtypy raka płuca, rozsianego raka jelita grubego, raka jajnika, zaawansowanego czerniaka, przewlekłą białaczkę szpikową, przewlekłą białaczkę limfocytową, ostrą białaczkę limfoblastyczną, szpiczaka plazmocytowego lub GIST, zapytaj swojego onkologa o możliwość wykonania bezpłatnego badania genetycznego. Skorzystaj z poniższej tabeli i sprawdź jakie badanie powinieneś wykonać lub skorzystaj z wyszukiwarki badań genetycznych Onkosnajper, a następnie zapytaj o nie swojego lekarza.
*) Uwaga: ze względu na to, że niektóre leki mogą być nierefundowane, również samo badanie genetyczne określające możliwość ich zastosowania może nie być refundowane w publicznych placówkach.
2. Wybór placówki przeprowadzającej badania genetyczne nowotworu
Jeżeli placówka/szpital, w którym się leczysz poinformuje Cię, że nie jest możliwe wykonanie w niej badania, poproś lekarza o udzielenie informacji gdzie takie badanie można wykonać.
Najprościej wykonać badanie genetyczne będąc pacjentem lekarza onkologa pracującego w placówce, która ma podpisaną umowę z NFZ na wykonywanie badań molekularnych. Jeżeli dopiero rozpoczynasz leczenie i poszukujesz odpowiedniego ośrodka, spróbuj zapisać się do takiego, który wykonuje badania genetyczne. Tam podczas wizyty u onkologa zapytaj o możliwość wykonania badań genetycznych Twojego nowotworu.
Jeżeli jesteś w trakcie leczenia skieruj się do ośrodka realizującego badania genetyczne. Tam podczas wizyty u onkologa poinformuj go o przebiegu dotychczasowego leczenia i zapytaj o możliwości wykonania badań genetycznych Twojego nowotworu w celu dostosowania Twojego leczenia. Jeżeli będzie taka możliwość pobrany zostanie od Ciebie materiał do badań. Jeżeli miałeś już wykonywane badania guza (biopsja) możesz zwrócić się do laboratorium diagnostycznego, w którym przechowywany jest materiał pobrany z Twojego guza o udostępnienie go. W kolejnym kroku przekażesz materiał do laboratorium placówki wykonującej badania molekularne.
Badanie genetyczne możesz wykonać również samodzielnie w placówkach realizujących je odpłatnie, wówczas nie będzie potrzebne Ci skierowanie.
Zapamiętaj!
Wszystkie laboratoria, które wykonują diagnostyczne badania molekularne, powinny posiadać odpowiednie certyfikaty i pozwolenia. Pacjent powinien to zweryfikować i zawnioskować o ich ujawnienie. W ten sposób chory będzie miał pewność, że badanie zostanie przeprowadzone poprawnie a wynik będzie wiarygodny (Grzanka D., 2015).
3. Wykonaj badanie genetyczne nowotworu
Badanie molekularne polega na pobraniu materiału genetycznego od chorego, najczęściej poprzez pobranie wycinków guza nowotworowego, komórek nowotworowych obecnych w płynach ustrojowych lub komórek krwi obwodowej.
Do pobrania nie trzeba się w żaden szczególny sposób przygotowywać. Materiał genetyczny komórki nie jest wrażliwy na większość stosowanych leków ani nie musi być pobierany na czczo.
Czas oczekiwania na wynik badania genetycznego to od 2 do 4 tygodni.
Wszystkie badania genetyczne, podobnie jak każde badanie medyczne jest objęte zasadą poufności i ochroną danych osobowych. Przed wykonaniem badania konieczne jest złożenie podpisu pacjenta lub jego opiekuna prawnego na formularzu świadomej zgody na wykonanie badań genetycznych. Dokument ten opisuje również zakres wykorzystania danych osobowych (są one wykorzystywane wyłącznie do przeprowadzenia badania) (Grzanka D., 2015).
4. Skonsultuj wynik badania genetycznego nowotworu z lekarzem prowadzącym
Po otrzymaniu wyniku badania guza nowotworowego, skonsultuj go ze swoim lekarzem prowadzącym i dowiedz się czy możesz być leczony jedną z terapii celowanych o udowodnionej skuteczności. Możesz skorzystać z poniższej tabeli lub wyszukiwarki Onkosnajper.
*) Uwaga: niektóre leki mogą być nierefundowane w Polsce – w takim przypadku dany lek nie może być zastosowany w leczeniu pacjenta w placówkach publicznych w ramach kontraktu z NFZ. Sytuacja refundacyjna zmienia się – nowe leki z czasem mogą zostać objęte refundacją.
**) Uwaga: ze względu na to, że niektóre leki mogą być nierefundowane, również samo badanie genetyczne określające możliwość ich zastosowania może nie być refundowane w publicznych placówkach.
Dostępność w Polsce
Dostępność w Polsce leczenia celowanego nowotworów.
Leczenie celowane, ukierunkowane molekularnie można aktualnie uznać za najskuteczniejszą formę terapii pacjentów onkologicznych. Nie uzyskało ono jednak powszechnego finansowania z Narodowego Funduszu Zdrowia (Grzanka D., 2015). Medycyna personalizowana to stosunkowo młode podejście, więc wdrożenie jego pełnego finansowania przez NFZ wymaga czasu. Niestety, funkcjonuje przekonanie, iż całościowe badania genetyczne są bardzo drogie. Jednak uwzględniając fakt, że leczenie celowane zmniejsza ryzyko efektów ubocznych i niepożądanych, a więc i konieczność hospitalizacji pacjenta, ostateczny bilans prezentuje się korzystnie. Zmniejszone bowiem zostają pośrednie koszty leczenia. Dodatkowo, leczenie w duchu medycyny personalizowanej, generuje oszczędności wydatków bezpośrednich, ponieważ stosuje się tylko leki działające na nowotwór, dopasowane do profilu genowego chorego, nie dobiera się ich metodą prób i błędów (Grzanka D., 2015).
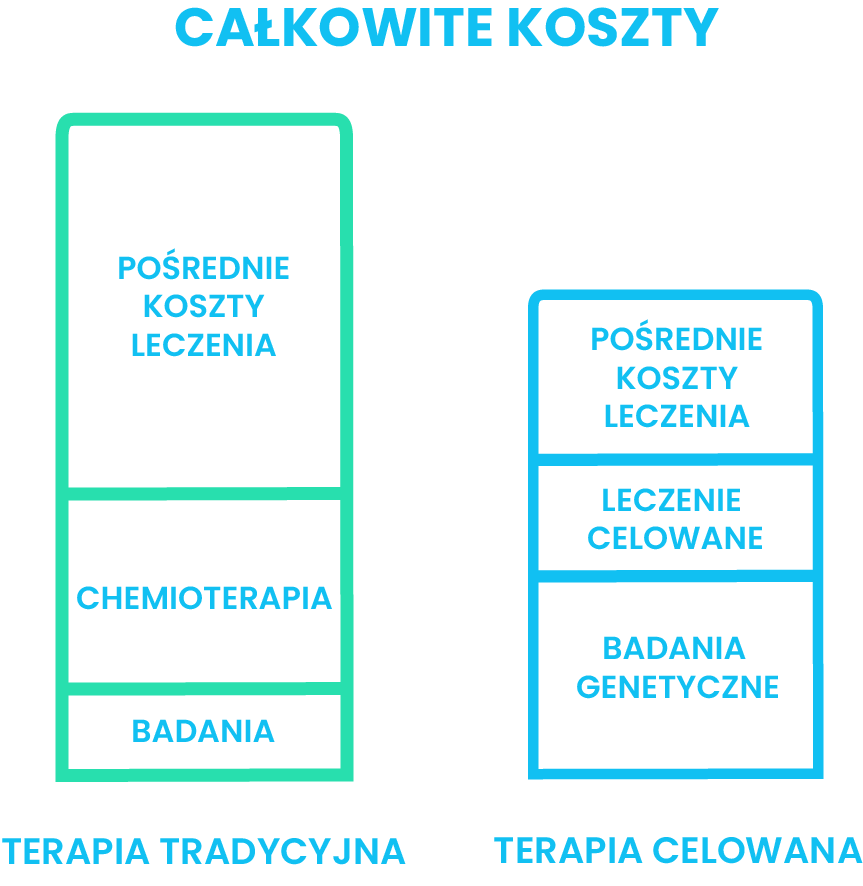
Finansowanie i dostępność badań genetycznych nie jest jedynym problemem dla polskich pacjentów onkologicznych. Nawet jeżeli osoba chora przeprowadzi badania molekularne i zostanie u niej wykryta konkretna mutacja, nie oznacza to, że zostanie wdrożone bezpłatne leczenie substancją oddziaływującą na jej typ nowotworu. Niestety, według stanu na dzisiaj (10.2016) w ramach terapii celowanych, nie istnieje leczenie dostępne bez żadnych ograniczeń. Większość nowoczesnych leków z tej grupy jest refundowana, ale pod pewnymi warunkami określonymi we wskazaniach do objęcia refundacją. W ten sposób, często zdarza się, że pacjent, któremu lek może potencjalnie pomóc nie kwalifikuje się do otrzymania go bezpłatnie. Dodatkowo niektóre leki nie są refundowane wcale.
W przypadku braku refundacji leku w Polsce – nie może być on zastosowany w leczeniu pacjenta w placówkach publicznych w ramach kontraktu z NFZ. Sytuacja refundacyjna zmienia się – nowe leki z czasem mogą zostać objęte refundacją.
Immunoterapia
Początki badań nad immunoterapią.
Już 3000 lat temu za czasów starożytnego Egiptu opisywano przypadki spontanicznego zniknięcia guza nowotworowego, które czasem wiązano z wystąpieniem infekcji z wysoką gorączką. W starożytnej Grecji, Galen opisywał podobieństwo między nowotworem i stanem zapalnym. Pierwsze naukowe próby wykorzystania układu odpornościowego pacjenta do walki z nowotworem przypisuje się dwóm niemieckim lekarzom, Fehleisenowi i Buschowi, którzy pracowali nad tym fenomenem w drugiej połowie XIX wieku. Ojcem immunoterapii nazwano jednak amerykańskiego chirurga, Williama Coleya, który poświęcił 43 lata na badanie procesu, w którym podając pacjentom inaktywowane bakterie (inaktywowane, czyli nie mogące wywołać choroby zakaźnej ale pobudzające układ odpornościowy) zaobserwował regresję bądź całkowite wyleczenie u przeszło 1000 pacjentów z nieoperacyjnym nowotworem. Kolejne prace nad wykorzystaniem immunoterapii w onkologii pojawiły się w połowie XIX wieku a w 2018 roku prace nad mechanizmami, w których nowotwór ucieka przed układem immunologicznym i możliwościami wykorzystania tego procesu w terapii onkologicznej, nagrodzono nagrodą Nobla.
Jak działa immunoterapia
Immunoterapia wykorzystuje naturalne możliwości organizmu – czyli jego układ odpornościowy (immunologiczny) – do walki z nowotworem. Może to się dziać poprzez bezpośrednią stymulację naturalnego układu odpornościowego albo przez podanie z zewnątrz cząsteczek – białek albo przeciwciał – które pomogą komórkom odpornościowym w realizacji ich zadań.
W przypadku niektórych nowotworów do zastosowania immunoterapii konieczne będzie wykonanie molekularnego badania kwalifikującego, takiego jak oznaczenie obecności cząsteczki PD-L1 czy też niestabilności mikrosatelitarnej oraz TMB, które wskazują na liczbę uszkodzeń genetycznych w komórkach nowotworowych. Im więcej uszkodzeń, tym komórka nowotworowa jest mniej podobna do prawidłowych komórek organizmu, a tym samym z większym prawdopodobieństwem zostanie przez układ odpornościowy rozpoznana jako obca i wymagająca zniszczenia.
Rodzaje immunoterapii
Pod pojęciem immunoterapii znajduje się wiele strategii leczniczych, których wspólnym mianownikiem jest wykorzystanie układu odpornościowego pacjenta do walki z nowotworem. Główne grupy terapeutyczne to przeciwciała monoklonalne, do których zaliczamy także inhibitory punktu kontrolnego oraz także szczepionki terapeutyczne czy CAR-T.
Przeciwciała monoklonalne
Przeciwciała to naturalnie występujące w naszym organizmie białka, które są produkowane przez komórki odpornościowe po kontakcie z komórką, którą nasz organizm rozpoznaje jako obcą. Przeciwciała monoklonalne stosowane w immunoterapii są produkowane w laboratorium. Celem najstarszej grupy leków z grupy przeciwciał monoklonalnych jest rozpoznanie pewnej grupy cząsteczek obecnych na powierzchni komórek nowotworowych, przyłączenie się do nich i zablokowanie komórkom możliwości dalszego wzrostu i podziałów. Do tej grupy związków należą cetuksymab, trastuzumab czy rytuksymab.
Przeciwciałami monoklonalnymi są też nowe leki zaliczane do grupy inhibitorów punktu kontrolnego (ang. Checkpoint inhibitors) – niwolumab, pembrolizumab czy ipilimumab. Ich rola polega na zdjęciu z komórek nowotworowych czapki-niewidki, dzięki której ukrywają się przed układem odpornościowym i, w efekcie, ich zniszczeniu.
Szczepionki terapeutyczne
Szczepionki, które są nam powszechnie znane, mają za zadanie uczulić nasz układ odpornościowy na zagrożenie z zewnątrz, takie jak wirus bądź bakteria. Celem szczepionek terapeutycznych jest wykorzystanie naszego układu immunologicznego do walki z nowotworem. Stworzenie ich wymaga poznania nowotworu danego pacjenta, a przede wszystkim genetycznego zapisu dla cząsteczek, które mogą zostać rozpoznane przez komórki odpornościowe. Tak jak zwykła szczepionka uczy układ odpornościowy rozpoznawania patogenów, tak szczepionka terapeutyczna rozpoczyna walkę z toczącą się już chorobą.
Cytokiny
Naturalne cytokiny wpływają na produkcję i aktywność komórek odpornościowych.
W terapiach onkologicznych interferon i aldesleukina są wykorzystywane coraz rzadziej, głównie w raku nerki, niektórych białaczkach i chłoniakach.
CAR – T
W terapii CAR-T wykorzystuje się jedne z komórek odpornościowych pacjenta – jego limfocyty T. Po pobraniu krwi, metodami biologii molekularnej limfocyty „uczy się” rozpoznawania nowotworu i podaje się je na powrót pacjentowi. Aktualnie terapię tę stosuje się w leczeniu nowotworów krwi.
Immunoterapia jest stosowana w coraz szerszej grupie nowotworów, a kolejne wskazania pojawiają się w ramach postępu toczących się od pewnego czasu badań klinicznych. Należy podkreślić, że pomimo ogromnej skuteczności tego rodzaju leczenia wciąż nie można go zastosować u wszystkich pacjentów, nie jest to także leczenie pozbawione skutków ubocznych – pobudzenie układu odpornościowego może bowiem doprowadzić do rozwinięcia chorób autoimmunologicznych czy nagłej reakcji zapalnej. Nie ulega jednak wątpliwości, że jest to bardzo obiecujący kierunek rozwoju terapii przeciwnowotworowych.
Źródła:
Fronczak A., 2016, Medycyna personalizowana. Mity, fakty , rekomendacje., Łódź.
Grzanka D., 2015, 10 faktów na temat terapii spersonalizowanej, www.alivia.org.pl.
Hsiao CJ , Hing E. Use and characteristics of electronic health record systems among office-based physician practices: United States, 2001–2013. NCHS data brief no. 143. Hyattsville, MD: US Department of Health and Human Services, CDC; 2014. http://www.cdc.gov/nchs/data/databriefs/db143.pdf.
Nikliński J., Niklińska W., Chyczewski L., 2000, Badania molekularne w rozpoznawaniu nowotworów, Borgis – Nowa Medycyna 10/2000.
Personalized Medicine Coalition. The Case for Personalized Medicine. 2011.
Personalized Medicine Coalition. The Case for Personalized Medicine. 2014.
Pieńkowska-Grela B. Cytogenetic testing in modern hematooncology and its place in the health care system. Journal of Health Policy, Insurance and Management. 2013, 12(2): 45-56
Tufts Center for the Study of Drug Development, “Personalized Medicine Gains Traction but Still Faces Multiple Challenges,” Impact Report, May/June 2015, Volume 17, Number 3.
Wysocki p., Kucharz E., Gaciong Z., Halota W., 2009, Medycyna personalizowana – jak dopasować leczenie do chorego, Puls Medycyny (wywiad przeprowadzony przez M. Marklowska Dzierżak).
Zielińska A., 2016, Medycyna Personalizowana – notatka z I Międzynarodowego Forum Medycyny Personalizowanej, http://www.doktora.pl/15-03-2016-kongres-medycyny-personalizowanej
Pytania i odpowiedzi
Najczęściej zadawane pytania
Co to są badania genetyczne?
Badania genetyczne to testy, które pozwalają na wykrycie zmian genetycznych (np. mutacji) w komórkach naszego ciała – w tkance nowotworowej lub/i w zdrowych komórkach.
W jaki sposób przeprowadza się badania genetyczne?
Badania genetyczne przeprowadzane są za pomocą testów laboratoryjnych. Do wykonania takiego badania potrzebny jest materiał genetyczny pacjenta, czyli DNA.
Gdzie znajduje się materiał genetyczny?
DNA znajduje się w każdej żywej komórce organizmu. W przypadku nowotworów właściwym materiałem jest DNA komórek guza, które może być badane pod kątem specyficznych mutacji.
Przeprowadzono u mnie biopsję i na tej podstawie zdiagnozowano nowotwór. Czy potrzebuję kolejnej biopsji, aby przeprowadzić badanie genetyczne raka?
Zazwyczaj biopsja, na podstawie której postawiono rozpoznanie nowotworu, jest wystarczającym materiałem do badań genetycznych i może być wykorzystana w tym celu. Niekiedy jednak w wyniku biopsji nie można uzyskać wystarczającej liczby komórek, aby przeprowadzić wiarygodne badanie genetyczne. W takich sytuacjach najczęściej należy przeprowadzić kolejną biopsję.
Dlaczego należy przeprowadzać badania genetyczne nowotworu?
Badania genetyczne w onkologii pełnią wieloraką rolę. Mogą stanowić element diagnozy raka, pomagać w postawieniu prawidłowego rozpoznania, bądź mówić o ryzyku zachorowania na niektóre nowotwory dziedziczne. Badania genetyczne mogą pokazać defekt genu, który może stać się celem terapii nazywanej terapią celowaną. Mają one również znaczenie rokownicze – wyniki takiego badania mogą pomóc w oszacowaniu odpowiedzi na podjęte leczenie, zwłaszcza leczenie celowane.
W przypadku jakich nowotworów przeprowadza się badania genetyczne?
Obecnie badania genetyczne przeprowadza się m.in. w przypadku takich nowotworów jak: rak piersi, rak płuca, rak jelita grubego, rak jajnika, czerniak, przewlekła białaczka szpikowa, przewlekła białaczka limfocytowa, nowotwory podścieliskowe przewodu pokarmowego (GIST).
Możliwe jest przeprowadzenie następujących badań w poszczególnych typach nowotworów:
*) Uwaga: ze względu na to, że niektóre leki mogą być nierefundowane, również samo badanie genetyczne określające możliwość ich zastosowania może nie być refundowane w publicznych placówkach.
Czy mogę wykonać badania genetyczne odpłatnie? Jaki jest ich koszt?
Badania genetyczne w kierunku mutacji warunkujących występowanie nowotworów dziedzicznych (przede wszystkim BRCA1 i BRCA2) można wykonać również odpłatnie w prywatnym laboratorium. Koszt takiego badania to około 2000 zł. Bardzo ważne jest uzyskanie profesjonalnej oceny wyników tak przeprowadzonego testu przez specjalistę – genetyka klinicznego.
Co to jest leczenie celowane?
Jest to terapia nakierowana na konkretne zaburzenie molekularne (nieprawidłowe białko będące najczęściej produktem zmutowanego genu). Lek celowany bierze sobie za cel nieprawidłowo działające białko obecne w komórkach nowotworowych, przez co bardzo precyzyjnie atakuje dany nowotwór. Leczenie celowane jest elementem medycyny personalizowanej.
Czy leczenie celowane działa podobnie jak chemioterapia?
Leczenie celowane, w przeciwieństwie do chemioterapii, działa głównie na komórki nowotworu. Charakteryzuje się innymi działaniami niepożądanymi, występuje najczęściej w formie doustnej i jest stosowane długotrwale, często codziennie.
Jaką przewagę nad chemioterapią ma leczenie celowane?
Leczenie celowane jest bardziej precyzyjne od chemioterapii. Skutkuje najczęściej większą skutecznością i lżejszymi efektami ubocznymi.
Mam raka piersi i zostałam poddana badaniu immunohistochemicznemu oceniającemu ilość białka HER2. Co jeśli status receptorów HER2 zostanie oceniony na 2+?
HER2 2+ oznacza, że wynik jest niejednoznaczny (graniczny) i potrzebne są dodatkowo badania genetyczne. Przeprowadzane są one metodami FISH lub CISH (fluorescencyjna lub chromogenna hybrydyzacja in situ), które pozwalają na bezpośredni pomiar liczby kopii genu HER2.
Mam wznowę raka piersi. Czy powinnam ponownie oznaczyć status receptora HER2?
W przypadkach uzasadnionych klinicznie takich jak wznowa, czy progresja choroby bądź przy pojawieniu się przerzutów wskazane jest ponowne oznaczenie statusu HER2, bowiem komórki nowotworowe po pewnym czasie mogą tracić lub zyskiwać ten receptor.
Rozpoznano u mnie gruczołowego raka płuca. Czy powinnam/powinienem mieć przeprowadzone badania genetyczne?
W przypadku rozpoznania gruczołowego raka płuca powinno się rutynowo oznaczyć status mutacji w genie EGFR oraz można dodatkowo ocenić tzw. rearanżację genu ALK.
Rozpoznano u mnie gruczołowego raka płuca, jednak nie zaproponowano mi określenia statusu genu ALK. Jaka jest tego przyczyna?
Diagnostyka genu ALK nie jest w Polsce wykonywana rutynowo. Związane jest to z faktem braku refundacji leku, który ma zastosowanie w przypadku identyfikacji mutacji ALK. Lek ten zarejestrowany jest w Unii Europejskiej, a diagnostyka i leczenie w Polsce możliwe jest niemal wyłącznie w ramach badań klinicznych.
Nigdy nie paliłam papierosów, a zdiagnozowano u mnie gruczołowego raka płuca. Czy jest to możliwe?
Mały odsetek nowotworów płuca rozwija się u osób, które nie były narażone na działanie dymu tytoniowego. Gruczołowy rak płuca jest częstszy właśnie w tej grupie chorych. Występuje on też częściej wśród kobiet.
Choruję na raka jelita grubego. Badania genetyczne potwierdziły u mnie obecność mutacji w genie KRAS. Czy oznacza to, że mogę otrzymać inhibitor EGFR?
W przypadku wykrycia mutacji w genie KRAS nie stosuje się inhibitorów EGFR. Na podstawie badań klinicznych wiemy, że inhibitory EGFR stosowane u chorych z mutacją KRAS lub NRAS pogarszają rokowanie. Inhibitory EGFR można zastosować wyłącznie w przypadku wykluczenia mutacji w genie KRAS oraz NRAS.
Jaka terapia jest możliwa w przypadku potwierdzenia zmutowanego genu KRAS?
Chorzy z mutacją KRAS mogą być leczeni standardową chemioterapią. Nie ma też przeciwwskazań do zastosowania terapii antyangiogennej, która w przypadku raka jelita grubego opiera się na podawaniu bewacyzumabu.
Choruję na raka jelita grubego. Lekarz proponuje mi terapię inhibitorami EGFR, czy powinnam/powinienem być przebadana/y pod kątem mutacji w genie EGFR?
W przypadku raka jelita grubego, nie zaleca się badania mutacji w genie EGFR. Mutacja w tym nowotworze (w odróżnieniu od raka płuca) nie występuje.
Zdiagnozowano u mnie raka jajnika pozytywnego w kierunku mutacji BRCA. Czy powinnam być leczona olaparibem?
Mutacja w genie BRCA jest kluczowym kryterium w ocenie kwalifikacji do leczenia olaparibem. Jednak musi być spełnione wiele innych warunków. Wskazaniem do zastosowania tego leku jest nawrotowy surowiczy rak jajnika o niskim stopniu zróżnicowania, który jest platynowrażliwy (uzyskano całkowitą lub częściową odpowiedź na leczenie związkami platyny).
Co to znaczy, że rak jajnika jest platynowrażliwy?
Oznacza to, że nawrót nowotworu nastąpił po >12 miesiącach od zakończenia terapii pochodnymi platyny. O częściowej platynowrażliwości mówimy, gdy nawrót pojawił się w okresie 6–12 miesięcy od zakończenia leczenia pochodnymi platyny.
Rozpoznano u mnie raka jajnika typu surowiczego. Czy można u mnie zastosować olaparib jako leczenie pierwszego rzutu?
Nie ma wskazań do stosowania olaparibu w początkowym etapie leczenia. Lek ten ma zastosowanie w tzw. leczeniu podtrzymującym, w przypadku nawrotu raka, który początkowo odpowiadał na leczenie preparatami platyny, tylko i wyłącznie w przypadku potwierdzenia obecności mutacji BRCA1 lub BRCA2.
Czy mogę przekazać zmutowany gen BRCA 1/2 moim dzieciom?
Istnieją dwa rodzaje mutacji BRCA 1/2, mutacje somatyczne (pojawiające się tylko w komórkach guza) i germinalne (inaczej wrodzone, obecne we wszystkich komórkach pacjentki). Jedynie mutacje wrodzone są dziedziczne i mogą być przekazywane potomstwu.
Choruję na czerniaka w stadium zaawansowanym. Wykluczono u mnie mutację w genie BRAF, w związku z tym nie mogę być leczony inhibitorami BRAF. Czy mogę otrzymywać inhibitory MEK?
Inhibitory MEK, podobnie jak inhibitory BRAF nie działają u pacjentów, którzy posiadają prawidłowe białko BRAF. Nie powinno się ich stosować u takich chorych ze względu na brak skuteczności i związane z leczeniem działania niepożądane.
Zdiagnozowano u mnie czerniaka błon śluzowych. Czy powinnam/powinienem mieć oznaczoną mutację w genie C-KIT?
Czerniak błon śluzowych, podobnie jak czerniak zlokalizowany na kończynach, pod paznokciami, oraz na skórze narażonej na ciągłą ekspozycję na słońce, wykazuje zwiększony odsetek mutacji w obrębie genu C-KIT. Z tego powodu zmiany zlokalizowane w takich miejscach powinny skłonić do poszukiwania mutacji C-KIT, aczkolwiek leczenie celowane w przypadku czerniaków z mutacją C-KIT jest w Polsce nierefundowane.
Choruję na przewlekłą białaczkę szpikową. Jakie badania kontrolne powinny być u mnie przeprowadzane?
W celu jak najlepszego monitorowania choroby pacjent musi być poddany następującym badaniom: morfologii, badaniu molekularnemu, cytogenetycznemu lub FISH a także punkcji szpiku. Morfologia wykonywana jest co tydzień bądź co dwa tygodnie. Kiedy zostanie osiągnięta tzw. remisja hematologiczna, czyli wartości morfologii wrócą do normy, badanie krwi zaleca się robić co dwa lub trzy miesiące. Badania molekularne należy przeprowadzać co trzy miesiące. Ocenia się w ten sposób tzw. remisję molekularną. Dodatkowo punkcja szpiku może być wykonywana co pół roku w celu oceny tzw. remisji cytogenetycznej. Obecnie wystarczające do oceny skuteczności leczenia jest monitorowanie molekularne z krwi obwodowej.
Czy konieczne jest wykonywanie punkcji szpiku?
Punkcja szpiku jest konieczna do określenia stanu szpiku na początku choroby oraz w niektórych przypadkach w trakcie leczenia.
Czy dzięki leczeniu imatynibem mogę być całkowicie wyleczony?
Zmiana genetyczna umiejscowiona jest w komórkach szpiku, które dają początek wszystkim komórkom krwi. Imatynib przeciwdziała skutkom mutacji, jednak nie usuwa nieprawidłowych komórek. Z tego powodu tylko przyjmowanie przewlekłe tego leku daje szansę na utrzymanie choroby w remisji. U niektórych chorych po dłuższym czasie terapii można podjąć próbę przerwania leczenia. Odbywa się to pod ścisłą kontrolą badań molekularnych i opieką hematologa, gdyż u ponad połowy chorych konieczny będzie powrót do terapii ze względu na nawrót molekularny choroby.
W ramach kontrolnej morfologii wykryto u mnie nieprawidłowe wartości limfocytów wskazujące na przewlekłą białaczkę limfocytową. Lekarz twierdzi, że w obecnym stadium nie muszę być leczona/leczony. Kiedy powinnam/powinienem rozpocząć leczenie?
W większości przypadków przewlekłą białaczkę limfocytową charakteryzuje powolny przebieg. U 1/3 pacjentów choroba nigdy nie będzie wymagała leczenia, u 1/3 wymaga leczenia w chwili rozpoznania a u 1/3 będzie kiedyś wymagała leczenia. Decyzja o podjęciu leczenia podejmowana jest w przypadku aktywności choroby, a więc w chwili występowania oznak, tj.: utraty masy ciała, uczucia przewlekłego zmęczenia, gorączki niezwiązanej z infekcją, nocnego pocenia, małopłytkowości i niedokrwistości, powiększenia śledziony, powiększenia węzłów chłonnych, wzrostu limfocytów.
Zostałam zoperowana/y z powodu GIST. Czy będę potrzebować leczenia celowanego?
Zależy to od wielu czynników. Twój lekarz oceni, jakie jest ryzyko, że nastąpi nawrót nowotworu. Weźmie pod uwagę m.in. lokalizację zmiany pierwotnej oraz tzw. indeks mitotyczny.
Wykryto u mnie mutację w genie C-KIT. Czy powinnam/powinienem być diagnozowana/y również pod kątem mutacji w genie PDGFRA?
Mutacje w genach C-KIT i PDGFRA wykluczają się wzajemnie. Oznacza to, że jeśli pacjent posiada mutację w genie C-KIT, to nie ma zmienionego genu PDGFRA i nie ma potrzeby przeprowadzania badania w tym kierunku.
Posiadam mutację w eksonie 9 genu C-KIT. Jakie ma to znaczenie?
Informacja ta jest istotna, gdyż wpływa na dawkowanie imatynibu (leku z wyboru w przypadku rozpoznania GIST). W przypadku mutacji w eksonie 9 potrzebna jest wyższa dawka leku, czyli 800mg/d.
